Comment le bon cholestérol tourne mal…
Comment un cholestérol protecteur du système cardio-vasculaire peut-il devenir nocif ? Une équipe de Berkeley a réussi à visualiser le mécanisme d'action de la protéine CETP impliquée dans cette transformation. Cette avancée est essentielle pour la recherche sur les médicaments "anti-cholestérol". Plongée dans l'infiniment petit.
Par Héloïse Rambert
Rédigé le , mis à jour le

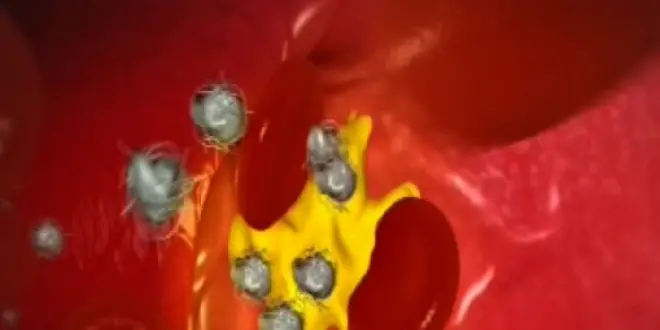
Comment le bon cholestérol se transforme-t-il en mauvais ?
Tout le monde est préoccupé par son taux de "bon" et de "mauvais" cholestérol. Les termes sont impropres, puisqu'il n'existe évidemment pas deux sortes de cholestérol… En revanche, celui-ci peut être transporté dans le sang par deux sortes de lipoprotéines : le LDL et le HDL. Et associé à l'une ou l'autre, il joue un rôle tout à fait différent dans notre santé cardiovasculaire.
Le LDL-cholestérol (le complexe formé par le cholestérol et son transporteur LDL) se dépose sur les parois des artères, forme des plaques d'athérosclérose, et constitue un risque majeur de maladies cardio-vasculaires. Le HDL-cholestérol, en revanche, est évacué par le foie et excrété. Il a donc un rôle d'"épuration" et de protection des artères. Logique, donc, que pour se prémunir des accidents cardio-vasculaires, il soit fondamental de maintenir un taux de LDL-cholestérol circulant le plus bas possible, et un taux de HDL-cholestérol le plus élevé possible.
Jusque-là, les chercheurs ont uniquement trouvé le moyen d'agir en faisant baisser le taux de LDL. C'est ce que font les médicaments "anticholestérol". "L'objectif actuel, pour la recherche, est de trouver le moyen de faire augmenter le taux sanguin de HDL-cholestérol protecteur", nous explique Laurent Lagrost, directeur du centre de recherche "lipides, nutrition, cancer" à l'Inserm.
La CETP, protéine de premier plan
Dans ces variations des taux de HDL et de LDL-cholestérol, le rôle majeur d'une protéine circulante, la CETP (Cholesterylester transfer protein), est établie depuis quelques années. Elle permet en effet le transfert du cholestérol des HDL aux LDL. En un mot, la protéine transforme notre "bon" cholestérol… en "mauvais". Un comble.
C'est justement à elle que l'équipe de Berkeley s'est intéressée. Car sa structure caractéristique, en forme de boomerang, est connue, mais son mécanisme d'action moléculaire l'était beaucoup moins. Comment interagit-elle avec le LDL et le HDL ? "Jusque-là, plusieurs théories s'opposaient", indique le Dr Lagrost. "Certains pensaient que la CETP faisait "la navette" entre les deux transporteurs lipoprotéiques, et d'autres penchaient pour la formation d'un complexe ternaire, formées de la protéine, du LDL et du HDL"
Une protéine "transformeuse"
La théorie du complexe ternaire, même si elle n'exclut pas totalement l'autre, vient d'être confirmée par l'équipe de Berkeley : les chercheurs l'ont observé par une technique de microscopie électronique et une reconstruction de l'image en trois dimensions. "Ce complexe ternaire n'avait jamais été vu de visu", commente le directeur de recherche de l'Inserm. C'est là toute l'importance des résultats de l'étude".
Et on sait désormais comment la CETP agit : elle "plante" une de ses extrémités dans la lipoprotéine de HDL et l'autre dans la lipoprotéine de LDL. S'en suit un changement de conformation de la protéine qui forme un "tunnel" en son centre, permettant ainsi de transférer le cholestérol des HDL vers les LDL.
Avancées thérapeutiques en vue
Maintenant que son mode d'action est mieux élucidé, tout l'enjeu est d'empêcher l'action de la protéine. "Les tentatives de développer des médicaments qui inhibent la CETP sont en cours" nous dit le Dr Lagrost. "Cette découverte va nous permettre de mieux connaître les sites d'action de la CETP, et donc de travailler plus efficacement au bloquer de son activité." Et c'est peu dire que les enjeux que soulève la recherche concernant les médicaments des maladies cardio-vasculaire sont colossaux…
Source : "Structural basis of transfer between lipoproteins by cholesteryl ester transfer protein", Nature Chemical Biology(2012)doi:10.1038/nchembio.796
En savoir plus
Sur Allodocteurs.fr :