Anticancéreux périmés : un laboratoire suisse suspendu
Les laboratoires Genopharm et Alkopharm sont accusés d’avoir laissé sur le marché des lots périmés d’un anticancéreux, après en avoir falsifié la date de péremption. L'agence suisse du médicament annonce la suspension d'Alkopharm. En France, l'Afssaps envisage une sanction similaire à l'encontre de Genopharm.
Par La rédaction d'Allo Docteurs
Rédigé le , mis à jour le
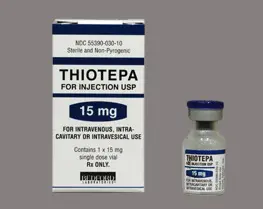
Flacon de Thiotepa®, commercialisé par Genopharm
Est-ce une nouvelle preuve du cynisme de certains laboratoires pharmaceutiques ?
Le Français Genopharm, affilié au Suisse Alkopharm, est en tout cas ciblé par la justice. Le laboratoire est accusé d'avoir falsifié les dates de péremption de lots de Thiotepa®, un anti-cancéreux utilisé notamment dans le traitement des leucémies.
L'affaire remonte au début de l'année, lorsqu'un laboratoire italien découvre sur le marché un flacon de Thiotepa®, commercialisé par Genopharm, avec une date de péremption suspecte. Il alerte le laboratoire allemand Riemser, fabricant du principe actif contenu dans le médicament. Or Riemser ne livrait plus rien à Genopharm depuis mars 2009. Ce flacon de Thiotepa® contenait donc un principe actif vieux de presque deux ans, alors qu'il est censé durer 18 mois !
Alertée par Riemser, l'Afssaps réalise en juin 2011 une inspection des laboratoires Genopharm. La falsification des documents sur la péremption des lots de Thiotepa® est alors mise au jour.
Ce médicament est un cytotoxique : dans les cas de leucémie par exemple, il permet de tuer les cellules souches cancéreuses avant de transplanter des cellules saines.
Selon les autorités de santé publique, un lot périmé de Thiotepa® ne présente pas de toxicité, mais les résultats d’analyse des laboratoires de contrôle de l'Afssaps ont montré que "la teneur en principe actif était inférieure aux normes en vigueur (86 % au lieu de 95 % minimum)". Il s'agirait donc "seulement" d'un sous-dosage, corrigé sur le moment en réajustant les doses pour chaque patient. Un sous-dosage néanmoins préoccupant dans le cadre d'un traitement de cancers graves.
Considérant donc que ces lots de Thiotepa® périmés "ne présentaient pas de risque avéré pour les malades", et en l'absence d'une possibilité d’approvisionnement immédiate, le produit est resté disponible jusqu'à l’arrivée d'une solution alternative – en l'occurrence le Tepadina®. Le Thiotepa® a été finalement retiré du marché en octobre 2011.
La sanction tombe ensuite sur le laboratoire aux pratiques suspectes : Swissmedic, l’agence française du médicament suisse, a décidé de suspendre au 30 novembre 2011 l'autorisation d'exploitation de l'entreprise Alkopharm, qui commercialisait le Thiotepa®. Un fait rarissime : il est désormais interdit au laboratoire "de fabriquer des médicaments, de réceptionner des livraisons de médicaments, ou de livrer, importer ou exporter des médicaments."
Côté français, l'Afssaps est en train de préparer une sanction similaire à l'encontre de Genopharm. Le projet de suspension a été signifié au laboratoire, mais la date n'a pas encore été arrêtée. "Avant cela, nous devons veiller à ce que le transfert des médicaments de Genopharm vers d'autres exploitants soit correctement organisé", explique-t-on à l'Afssaps.
Pour en savoir plus
Sur Bonjour-docteur :
Et aussi :