L'Europe ne suit pas la France sur la suspension de Diane 35®
À compter de ce mardi 21 mai 2013, Diane 35® et ses génériques, un traitement contre l'acné largement prescrit en France comme contraceptif oral, ne sont plus disponibles en pharmacie. L'Agence européenne du médicament (EMA) n'a pas suivi la France sur la suspension du traitement estimant les bénéfices de ce médicament supérieurs aux risques thrombo-emboliques pour certaines patientes, selon un communiqué du 17 mai 2013.
Par La rédaction d'Allo Docteurs
Rédigé le
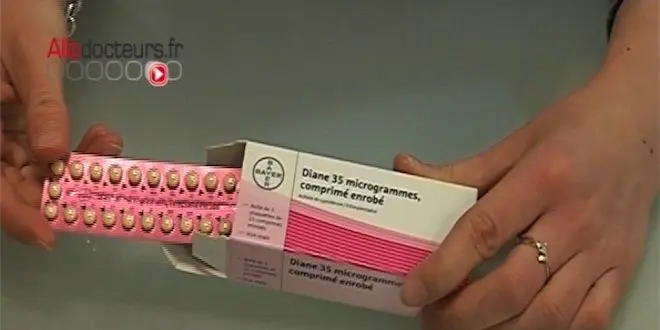
Après avoir été suspendue par les autorités sanitaires françaises en janvier 2013, Diane 35® voit son blason redoré par l'Agence européenne du médicament (EMA). En effet, celle-ci a estimé que les bénéfices de ce médicament contre l'acné dépassent les risques pour "certaines populations de patientes".
"Le Comité pour l'évaluation des risques en matière de pharmacovigilance (PRAC) de l'Agence européenne du médicament a conclu que le rapport bénéfice/risque de Diane 35® et de ses génériques est positif, à condition que certaines mesures soient prises pour minimiser les risques thrombo-emboliques", à savoir de formation de caillots sanguins, selon un communiqué de l'EMA.
Ce comité ne s'est donc pas prononcé en faveur d'une suspension de ce traitement comme l'avait décidé pour la France l'Agence française du médicament, ANSM, fin janvier 2013. Mais il souligne que ces médicaments doivent être utilisés uniquement pour le traitement de l'acné modérée ou sévère et/ou pour le traitement de l'hirsutisme, une pilosité excessive.
L'EMA ne se prononce pas sur l'utilisation de ce médicament comme contraceptif, puisque son fabricant n'a obtenu d'autorisation de mise sur le marché qu'en tant que produit anti-acné ou pilosité.
L'EMA relève cependant que le Diane 35® a des propriétés de pilule contraceptive et qu'il ne doit donc pas être utilisé en combinaison avec un autre contraceptif hormonal.
L'Agence européenne du médicament (EMA) reconnaît également que des mesures additionnelles pour minimiser les risques thrombo-emboliques associés à ces médicaments sont nécessaires.
Elle recommande de nouvelles contre-indications et avertissements à l'attention des patients et professionnels de santé avec une sensibilisation sur les risques, signes et symptômes des thromboses, afin que le diagnostic et le traitement soient envisagés dans les meilleurs délais.
Ces recommandations seront maintenant examinées le 27 et 29 mai 2013 par le groupe de coordination pour les procédures de reconnaissance mutuelle et décentralisée - médicaments à usage humain (CMDh), l'entité européenne représentant les agences nationales du médicament.
En savoir plus
Sur Allodocteurs.fr :