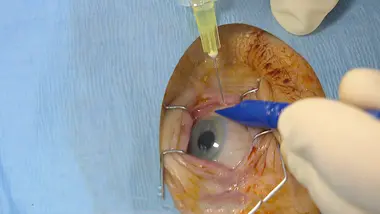
DMLA : l'Avastin® reste autorisé d'ici au jugement définitif du Conseil d'Etat
Ce 21 septembre, le Conseil d’Etat a décidé de maintenir l’autorisation de l’Avastin® pour le DMLA en attendant la décision définitive des magistrats. Le groupe Roche, qui commercialise l’Avastin® réclamait cette suspension temporaire.
Par La rédaction d'Allo Docteurs
Rédigé le , mis à jour le

En juin, l'Agence française du médicament (ANSM) a attribué à l’Avastin®, produit par le laboratoire Roche, une autorisation temporaire d'utilisation de trois ans pour traiter la dégénérescence maculaire liée à l'âge (DMLA).
Un autre médicament très proche de l'Avastin®, le Lucentis® dispose depuis des années d'une autorisation spécifique pour la DMLA. Mais ce Lucentis® coûte 20 fois plus cher que l’Avastin®. Pour le gouvernement, l'autorisation de l'Avastin® pour traiter la DMLA doit permettre de réaliser d'importantes économies.
Déterminé à combattre cette autorisation, Roche avait demandé au Conseil d'Etat de la suspendre dans le cadre d'une procédure en urgence dite de "référé-suspension", en attendant le jugement définitif. Mais cette juridiction a rejeté cette demande, estimant que les arguments développés par Roche ne faisaient pas sérieusement douter de la légalité de l'autorisation temporaire de l'Avastin® pour la DMLA.
En particulier, le Conseil d'Etat a estimé que le dispositif légal français qui permet à l'ANSM d'élargir l'utilisation d'un médicament au-delà de ce que prévoit son autorisation initiale de mise sur le marché, n'apparaissait pas contraire au droit européen.
L'autorisation d'utilisation restera donc valable jusqu'à ce que le Conseil d'Etat se prononce définitivement sur la légalité de cette décision administrative, précise cette instance.
Roche a "pris acte de la décision". "Nous ne recommandons pas cette utilisation, pour nous elle est contraire à l'intérêt du patient, notre point de vue n'a pas changé", a rappelé lundi un porte-parole ajoutant que cette première décision ne "préjugeait en rien de la décision qui sera rendue sur le fond".
Développé par Roche, le Lucentis® est produit et commercialisé par Novartis (Roche perçoit des royalties sur les ventes réalisées par Novartis sur ce traitement).
L'Avastin® (bévacizumab) agit en réduisant la croissance des vaisseaux sanguins nécessaires au développement des tumeurs cancéreuses. Comme le Lucentis® (ranibizumab), il agit également sur le développement des vaisseaux à l'origine de la DMLA.