Essure® : pas de suspension provisoire, au regret des associations
Un comité d'experts indépendants, nommé par l'ANSM, a jugé ce 20 avril qu'il fallait améliorer l'information des patientes sur l’implant Essure®, tout en jugeant qu’il n'était "pas nécessaire" de restreindre son utilisation. Resist, l'association de patientes qui dénonce les risques de ce dispositif de contraception définitive, s’est déclarée "un peu déçue" de cette décision.
Par La rédaction d'Allo Docteurs
Rédigé le , mis à jour le

Un comité d'experts indépendants chargé par l'ANSM d'évaluer les risques liés à l'implant Essure® a estimé ce 20 avril qu'il n’était "pas nécessaire" de modifier la réglementation sur ce dispositif. Unanimement, ses huit membres ont conclu que les données disponibles "[ne remettaient pas] en cause la balance bénéfices/risques favorable de l'implant Essure®", et que "de nouvelles conditions en termes de réglementation [n’étaient] pas nécessaires"
Le comité recommande en revanche de mieux informer les femmes envisageant cette méthode des risques et des "possibilités d'échec", "afin de permettre une décision éclairée". Le groupe d'experts a appuyé sa décision sur l'audition de patientes, d'associations d'information sur la contraception et de gynécologues, ainsi que sur de nouvelles données présentées par l'ANSM.
Les associations déçues
L'association Resist (Réseau d'entraide soutien et information sur la stérilisation tubulaire [1]), a exprimé sa déception après cette annonce. "On aurait aimé, en attendant [les résultats d'études complémentaires], [que le comité] recommande une suspension" des nouvelles implantations, a regretté sa vice-présidente, Isabelle Ellis, contactée par l'Agence France Presse. "Pour notre part, nous maintenons notre position. Nous disons aux femmes : « Appliquez-vous vous-même le principe de précaution »", a-t-elle ajouté.
Elle s'est malgré tout dite "satisfaite d'avoir pu échanger" avec les huit membres du comité, lors des auditions organisées le 19 avril. "Nous avons pu faire entendre nos préoccupations" sur la toxicité de l'implant, sur le besoin de comprendre le "syndrome inflammatoire" dont souffrent certaines femmes et sur la nécessité d'améliorer l'information des patientes.
"Il faut que les gynécologues soient vraiment clairs : on ne sait pas comment l'implant va vieillir, il y a des risques d'échecs et de complications, et s'il faut l'enlever, il faut passer par une ablation des trompes voire de l'utérus", a-t-elle souligné.
Bayer - qui commercialise l’implant - a de son côté déclaré "prendre acte" de l'avis du comité d'experts. "Nous continuons à travailler avec les autorités pour mettre en place plus d'informations pour la patiente autour du dispositif et renforcer le contrôle médical à trois mois après la pause", ajoute le laboratoire. Depuis 2001, environ 1 million d'unités du dispositif médical Essure® ont été vendues dans le monde, dont 240.000 en France, selon le laboratoire Bayer.
[nextpage]
[1] Resist compte 1.200 adhérentes, a recueilli de nombreux témoignages de femmes signalant des effets secondaires très divers quelque temps après l'implantation : certains de type gynécologique (saignements et douleurs dans la région abdominale) et d'autres de nature différente (douleurs dans d'autres zones, forte fatigue, réaction allergique, dépression...).
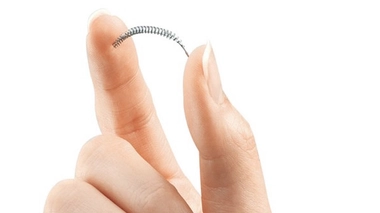
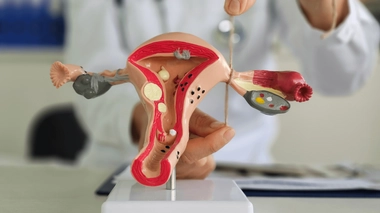
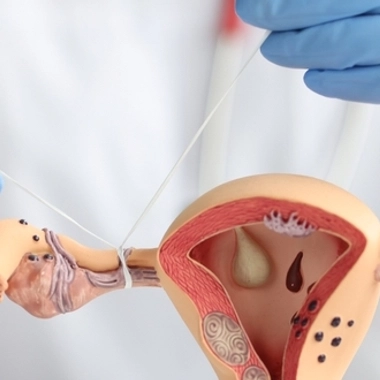
La stérilisation (ou "contraception définitive") par l'implant Essure® du laboratoire Bayer, méthode recommandée prioritairement en France depuis plusieurs années, consiste à insérer un petit ressort métallique dans les trompes de Fallope, où il provoque une cicatrisation qui les obstrue.
Ce dispositif, commercialisé en France depuis 2002, a été placé sous surveillance renforcée en 2015 par l'ANSM, suite à une recrudescence des signalements d'effets indésirables.
Dans un nouveau bilan, l’ANSM a ainsi annoncé que 1.087 femmes ont été confrontées à un dysfonctionnement du dispositif ou à la survenue d'effets indésirables entre 2003 et début février 2017.