Taxotère Accord : six questions autour d'un anticancéreux soupçonné d'avoir entraîné des décès
Selon une information du Figaro confirmée par l’ANSM, cinq femmes sont décédées après la prise d’un traitement anticancéreux générique, dans la version produite par le laboratoire indien Accord.
Par La rédaction d'Allo Docteurs
Rédigé le , mis à jour le
Quelle est la chronologie des principaux faits ?
Selon une information du Figaro, confirmée par l’ANSM, début août 2015, des médecins de l’Institut Gustave-Roussy contactent l’Agence du médicament pour leur annoncer que, depuis avril quatre patientes traitées par un médicament contenant du docétaxel ont déclaré une entérocolite (inflammation simultanée des muqueuses de l'intestin grêle et du côlon). Parmi elles, trois sont décédés d'un choc septique. Le médicament incriminé est un générique du Taxotère fabriqué par le laboratoire indien Accord (Intas Pharmaceuticals). Suite à ce signalement, deux autres décès ont été signalés à l’ANSM.
Les six accidents concernent des femmes âgées de 46 à 73 ans atteintes d'un cancer du sein.
Une enquête de pharmacovigilance a été ouverte par l’ANSM en septembre 2016 "sur les médicaments contenant du docétaxel".
Qu’est-ce que le docétaxel ?
Inscrit sur la liste des médicaments indispensables de l’OMS, le docétaxel est un traitement anticancéreux synthétisé en 1989 par des chercheurs du CNRS à partir d’un extrait d’if. Il est autorisé en France dans le traitement des cancers (du sein, du poumon, de la prostate, du cancer gastrique et des voies aéro-digestives supérieures), et plus précisément pour la prévention des récidives. Initialement commercialisé par Sanofi, le médicament (à divers dosages) est aujourd’hui produit par de nombreux laboratoires.
Quel(s) médicament(s) à base de docétaxel sont concernés ?
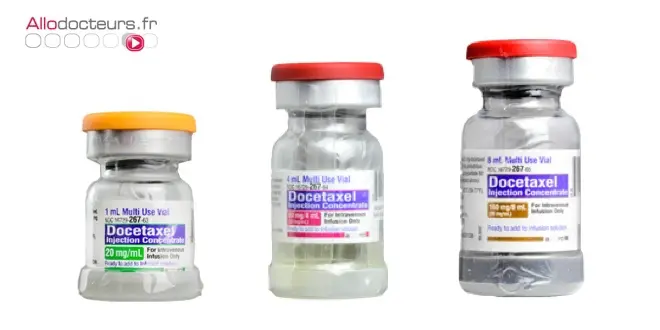
Selon les informations du Figaro, les trois décès à l’origine du signalement seraient tous reliés à l’utilisation de lots de traitement commercialisé par le laboratoire indien Accord (Intas Pharmaceuticals). Le quotidien se réfère à un document confidentiel interne entre les 31 centres de pharmacovigilance et l’ANSM, qui précise que "le même lot (S15456) a été utilisé pour trois patientes (deux cas de décès plus un cas d’entérocolite grade 4) et un troisième décès avec un second lot (PT00345)", tous produits par ce laboratoire.
Où en est l’enquête de l’ANSM ?
Selon l’ANSM, l’enquête sur les décès "est en cours de finalisation" et sera présentée le 28 mars à un comité technique de l'agence. Pour l’heure, celle-ci ne recommande pas l'arrêt des médicaments contenant cette molécule. "Aucune recommandation n'est formulée à date en l'absence d'éléments complémentaires d'investigation permettant d'évaluer le rapport bénéfice/risque dans le cadre du traitement du cancer du sein", écrit l'ANSM dans un courrier adressé aux professionnels de santé.
En outre, pour l’heure, aucune information ne suggère que d’autres lots produits par Accord, ou que des lots de traitements intégrant du docétaxel, aient été responsables d’accidents.
Selon le directeur général de l'ANSM, Dominique Martin, interrogé par l’AFP, les analyses déjà menées "ont montré qu'il n'y aurait pas de problématique qui serait liée au fait que le générique serait différent du princeps (médicament initialement commercialisé sous une marque), dans sa concentration ou autre chose. Il n'y a pas de différence, il est tout à fait dans les normes".
Pour l’heure, selon une lettre de l’ANSM envoyée ce 15 février aux professionnels de santé, "aucune recommandation n’est formulée à date en l’absence d’éléments complémentaires d’investigation".
Si le docétaxel venait à être incriminé, existe-t-il une alternative pour les patients ?
L'Agence nationale de sécurité du médicament et des produits de santé souligne qu'une autre molécule, le paclitaxel, "peut constituer une alternative dans certaines situations".
Quelles sont les réactions du laboratoire Accord ?
Contacté par Le Figaro, Jean-Paul Drouhin, pharmacien responsable de la filiale française d’Accord (Intas Pharmaceuticals), a déclaré que "tous les médicaments ont des effets indésirables. Il n’y a rien de particulier. Il n’y a aucun problème. Le nombre de décès éventuellement rapporté au global en France est tout à fait dans les normes. L’ANSM a confié une étude au centre de Toulouse. Ce n’est pas un problème de molécule, mais il va falloir exclure une partie de la population [qui ne supporterait pas le traitement]".
la rédaction d'Allodocteurs.fr, avec AFP