DMLA : Roche perd la bataille de l'Avastin®
Dernier rebondissement dans le feuilleton pharmaceutique qui oppose Roche à l'Etat. L'Avastin® sera bel et bien utilisé pour traiter la dégénérescence maculaire liée à l'âge, contre l'avis du laboratoire Roche, qui fabrique à l'origine ce médicament contre le cancer. A la clé, l'Etat promet de belles économies : ce traitement est facturé trente fois moins cher que son concurrent, Lucentis®.
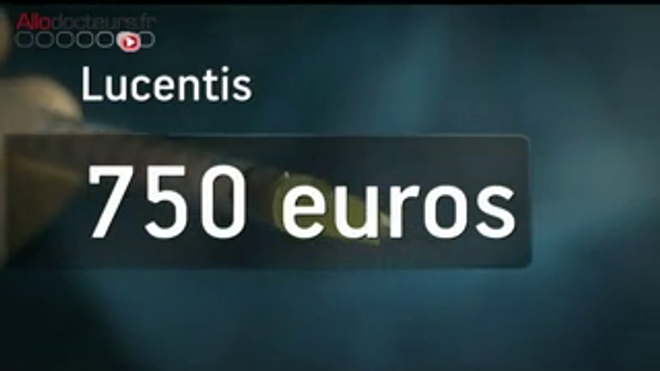
Depuis 2012, les deux camps comptent les points… Mais la partie semble finalement perdue pour le géant pharmaceutique suisse Roche, qui commercialise l'Avastin®. A plusieurs reprises, le laboratoire a réaffirmé son opposition à l'utilisation de son produit pour traiter la DMLA, commercialisé à l'origine contre le cancer. Pourtant, ce dernier coûte trente fois moins cher que l'autre traitement prescrit contre la DMLA, le Lucentis®. Alors qu'une injection de Lucentis® est facturée 895 euros, elle coûterait une dizaine d'euros pour l'Avastin®, à efficacité égale. Le remboursement de ces injections pèse dans le budget de la Sécurité Sociale et représente même le premier poste de dépense de la Sécu…
La découverte des propriétés ophtalmologiques de l'Avastin® se révèle être une aubaine pour la réduction des dépenses publiques. Le 27 août, le gouvernement force la main à Roche pour pouvoir mettre en place un décret d'application permettant une utilisation temporaire de l'Avastin® dans le traitement de la DMLA. Elle prendra effet le 1er septembre 2015 et "permettra la réalisation d’importantes économies, et ce dans le respect de la sécurité des patients" a commenté la ministre de la Santé, Marisol Touraine, dans un communiqué.
Pourquoi Roche refuse l'utilisation de son propre traitement ?
Pour la première fois, l'utilisation temporaire d'un médicament est décrétée sans l'accord du laboratoire fabricant. Car le refus de Roche relève d'arrangements strictement financiers avec son concurrent Novartis, fabricant du très coûteux Lucentis®. Les deux firmes sont soupçonnées d'accords illégaux, faussant la concurrence. L'affaire est en cours depuis 2014, date à laquelle l'autorité de la concurrence a perquisitionné les locaux des laboratoires. Une procédure rarissime.
A l'origine, le Lucentis® a été développé par Roche, qui a finalement laissé sa commercialisation à Novartis, lequel lui verse des royalties sur les ventes réalisées. Il est facile donc de comprendre pourquoi Roche s'oppose à l'utilisation de son propre médicament. D'autant plus que les intérêts financiers des deux laboratoires sont étroitement liés : Novartis détient un tiers du capital de Roche.
Un espoir d'économies pour la Sécu
Faute de demande d'utilisation par le fabricant, la situation de l'Avastin® est restée au point mort jusqu'en 2014. Il y a un an, l'Assemblée a voté un loi autorisant l'utilisation temporaire d'un médicament pour des motifs purement économiques, reprenant les rênes de l'affaire Avastin®.
Le seul intérêt de ce médicament est d'être moins cher. Comparé au Lucentis®, l'Avastin® possède la même efficacité et les mêmes effets secondaires. Depuis 2012, six études ont confirmé ces résultats. Des conclusions peu étonnantes, car les deux molécules, le ranibizumab et le bevacizumab, sont extrêmement proches. Tous deux s'attaquent à la formation de néovaisseaux, alimentant les tumeurs. Ainsi, si le Lucentis® est utilisé en ophtalmologie, il pourrait également traiter les cancers, comme le précisait en 2014 au Magazine de la Santé, François Chast, chef de service pharmacie Hôpital Cochin.
L'Avastin® plus cher que prévu ?
Fort de ces résultats, l'Agence française du médicament (ANSM) a voté à l'unanimité pour la recommandation d'utilisation temporaire(1) de l'Avastin® chez les malades souffrant de DMLA. Il sera mis à l'essai pour une durée de trois ans renoublables, dans certains hôpitaux de la région parisienne et lyonnaise, par exemple. L'utilisation temporaire devra se dérouler dans des conditions d'administration strictes, réservée au personnel hospitalier.
Une question se pose alors pour les pharmaciens hospitaliers : comment reconditionner une solution anticancéreuse administrée habituellement en perfusion ? Selon l'ANSM, l'Avastin® doit être injecté dans l'œil grâce à des seringues intra-vitréenne. A cause de ce reconditionnement, la facture de l'Avastin® pourrait alors être plus salée que prévue… Passant de 10 euros, selon la publication au Journal Officiel, à 78 euros selon Le Monde.
Eponger 5% du déficit de la Sécurité sociale
Jusqu'alors, la France était le seul pays au monde où l'Avastin® était proscrit dans le traitement de la DMLA. Aux Etats-Unis, 55% des malades sont traités par la molécule. Une des pistes d'amélioration pour le conditionnement pourrait se trouver en Allemagne, où un laboratoire (Apozyt) commercialise directement l'Avastin® aux doses adaptées pour le traitement de la maladie oculaire. Début 2013, Novartis avait attaqué le laboratoire pour concurrence déloyale devant la Cour européenne, avant d'être débouté…
Même si elle s'avérait plus chère que prévue, l'utilisation de l'Avastin® devrait permettre de faire des économies considérables en épongeant près de 5% du déficit de la Sécu, selon François Chast (2). Le médicament est prescrit pour le traitement de la forme humide de la DMLA, soit 20% des cas. En France, cette dégénérescence reste la première cause de malvoyance des plus de 50 ans.
---
(1) La Recommandation d'Utilisation Temporaire (RTU) permet d'utiliser un médicament en dehors de son usage primaire
(2) Estimation basée sur l'Avastin® à une trentaine d'euros
Contre une utilisation systématique de l'Avastin® ?
L'Association DMLA, qui regroupe malades et ophtalmologistes, s'est prononcée contre une utilisation systématique de l'Avastin® lorsqu'elle est uniquement motivée par des raisons d'économie budgétaire. Elle réclame ainsi, selon l'AFP, "le libre choix de prescription pour les ophtalmologistes traitant en milieu hospitalier". Pour l'association, le reconditionnement pourrait entraîner une éventuelle augmentation des effets secondaires gastro-intestinaux et des risques d'inflammations de l'œil. Elle insiste donc sur l'importance de bien informer les patients.
L'Agence du médicament a pour sa part déjà évalué les bénéfices et les risques de l'Avastin®, dans des conditions de reconditionnement optimales. "Aucune différence significative n’a été démontrée entre Avastin® et Lucentis®, hormis la survenue d’effets gastro-intestinaux. Les effets indésirables oculaires observés (effets inflammatoires ou traumatiques) sont ceux de tous les anti-angiogéniques administrés par voie intra-vitréenne tels que des infections intraoculaires (endophtalmies) principalement liées ici au mode de préparation d’Avastin®. Celui-ci sera strictement encadré lors de la mise en place de la RTU", rassure l'ANSM.
