Essai clinique Biotrial : des données médicales rendues publiques
Les données médicales de quatre patients, hospitalisés suite à l’essai clinique mortel de Rennes en janvier 2016, ont été publiées ce 3 novembre dans une revue médicale. Elles appuient l’hypothèse d’une toxicité directe de la molécule testée.
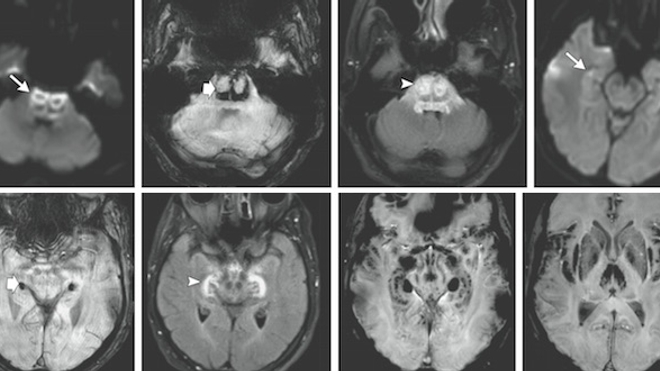
En janvier, l'essai clinique d'une molécule censée soulager la douleur et l'anxiété (mené par la société Biotrial pour le compte du groupe pharmaceutique portugais Bial) avait conduit à l'hospitalisation de six volontaires par le CHU de Rennes. L'un d'entre eux est mort, quatre ont subi des lésions cérébrales.
"Si ce type d'accident est très exceptionnel, il est par essence intolérable", explique dans un communiqué de presse l'équipe de soignants, composée de cinq neurologues, trois neuro-radiologues et trois réanimateurs. "C'est la raison pour laquelle il est apparu fondamental aux équipes médicales du CHU de Rennes ayant pris en charge ces patients de mettre à disposition les données scientifiques dont elles disposaient".
Une molécule toxique aux doses testées
Dans un article publié dans la revue américaine New England Journal of Medicine (NEJM), l'équipe décrit les symptômes cliniques et les IRM du patient décédé le 17 janvier, de deux patients ayant souffert de "troubles sérieux" et d'un participant à l'essai qui n'a pas manifesté de symptômes. Les deux autres participants hospitalisés, qui avaient eux aussi manifesté des troubles sérieux, n'ont pas donné leur autorisation pour apparaître dans l'article [1].
Selon l'équipe du CHU de Rennes, les lésions cérébrales et les signes cliniques des patients hospitalisés suggèrent une "toxicité directe" de la molécule testée (BIA 10-2474), mais le "mécanisme sous-jacent" de cette toxicité "reste inconnu". Des conclusions qui rejoignent celles formulées par les experts de l'ANSM.
L'autopsie du patient décédé n'a pas été rendue publique, soulignent les soignants.
Renforcer les règles encadrant les essais cliniques
Après cet accident, deux groupes de travail ont été créés au sein de l'Agence européenne du médicament (EMA), afin de réfléchir à la manière de renforcer la protection des volontaires sains dans les essais cliniques.
"Les leçons des échecs et des effets indésirables lors des essais cliniques doivent aider les régulateurs à développer des stratégies pour rendre le développement des médicaments plus sûr", ont plaidé Sergio Bonini et Guido Rasi, respectivement membre du comité scientifique et directeur exécutif de l'EMA, dans un éditorial publié par le NEJM.
Un article trop factuel ?
L’équipe rennaise conclut à "la survenue non anticipée de troubles neurologiques sévères [après ingestion d’une forte dose de la molécule]"…
Interrogé par le Figaro, le Pr Alain Privat, neurobiologiste et membre de l’Académie de médecine, met en exergue deux mots : "non anticipée"… Selon lui, ils démontrent "que cet article n’est pas honnête", et qu’il "pèche par erreur et par omission".
"Qui a laissé l’essai clinique de Rennes aller aussi loin en dépit de toute logique ?", peut-on lire dans le quotidien. "Dès les premières doses les plus faibles, il y avait une inhibition complète de la FAAH à des concentrations vingt fois plus faibles que chez l’animal", remarque le Pr Privat. "Cela aurait dû entraîner une remise à plat du protocole de la part de Biotrial. Et la publication se garde bien de le dire."
avec AFP
Sources :
- Acute Neurologic Disorder from an Inhibitor of Fatty Acid Amide Hydrolase. A. Kerbrat et al. NEJM, 3 nov. 2016. doi:10.1056/NEJMoa1604221
- First-in-Human Clinical Trials - What We Can Learn from Tragic Failures. S. Bonini & G. Rasi. NEJM, 2 nov 2016. doi:10.1056/NEJMe1609006
[1] Ces patients hospitalisés sont ceux qui avaient reçu la plus forte dose du BIA 10-2474 (50 mg par jour) au cours de l’essai. Dans les phases précédentes de l'essai, 84 volontaires avaient reçu des doses allant jusqu'à 20 mg par jour pendant 10 jours, sans qu'aucun effet secondaire grave n'ait été rapporté.
