Dépakine® : le parquet de Paris a ouvert une enquête
Le parquet de Paris a ouvert fin septembre 2015 une enquête sur les conditions d'autorisation et de commercialisation des antiépileptiques Dépakine® ainsi que sur les risques auxquels sont exposées les femmes enceintes suivant ce traitement.
Par La rédaction d'Allo Docteurs
Rédigé le , mis à jour le

L'enquête a été ouverte pour "blessures involontaires et tromperie aggravée". Le service de gendarmerie spécialisé dans les atteintes à l'environnement et à la santé publique (Oclaesp) va également être saisi.
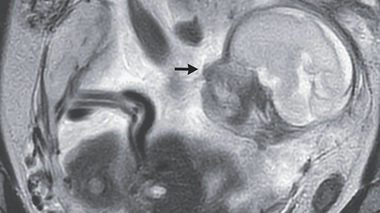
Les médicaments à base de valproate (Dépakine®, commercialisé par Sanofi Aventis, génériques et dérivés) servent à traiter l'épilepsie et certains troubles psychiatriques. Leurs conditions de prescription ont déjà été durcies par l'Agence nationale du médicament (ANSM). Elle rappelait en mai dernier le "risque élevé de malformations congénitales" et le risque accru de troubles neuro-développementaux (autisme, retard d’acquisition du langage et/ou de la marche jusqu'à 30 à 40% des cas) pour les enfants exposés in utero.
Ces médicaments ne doivent pas être prescrits aux filles et aux femmes en âge de procréer, ni aux femmes enceintes, "sauf en cas d'inefficacité ou d'intolérance aux alternatives médicamenteuses", notait l'ANSM, qui prônait dans ces cas "une contraception efficace pendant le traitement".
La ministre de la Santé Marisol Touraine a saisi l'Inspection générale des affaires sociales sur ce même sujet (Igas) en juillet dernier.