Elle guérit d'une maladie génétique grave ''sans rien faire''
Une femme, atteinte du premier cas connu de WHIM (une maladie génétique rare affaiblissant l'immunité) s'est révélée en parfaite santé 50 ans après le diagnostic initial. Stupéfaction des biologistes invités à étudier son cas : au cœur des cellules productrices de globules blancs, le chromosome porteur du gène déficient s'est modifié pour éradiquer l'anomalie. La découverte, publiée début février 2015 dans la prestigieuse revue Cell et rapidement commentée par Science, soulève de nombreuses et passionnantes questions.
Rédigé le , mis à jour le

L'article original du New England Journal of Medicine décrivant le cas de la fillette de Cincinatti
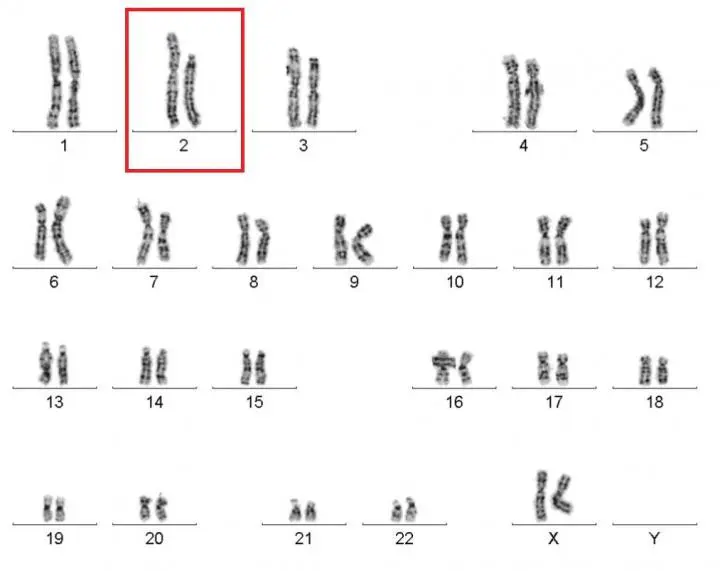
Le caryotype des globules blancs de la patiente (le caryotype désigne l'arrangement standard des chromosomes d'une cellule) - image : NIAID
L'incroyable récit débute en 1963 à Cincinatti (Etats-Unis). Face à trois éminents médecins, une mère désespérée, et une fillette de 9 ans couverte de verrues. Perpétuellement malade, l'enfant présente un taux de globules blancs incroyablement faible. Le cas, décrit l'année suivante dans le New England Journal of Medicine, restera longtemps isolé.
Au fil des décennies apparaitront dans la littérature médicale quelques descriptions analogues. La pathologie est finalement baptisée "WHIM", l'anagramme anglais(1) de ses quatre symptômes : verrues, infections fréquentes, hypogammaglobulinémie (faible nombre d'immunoglobulines, essentiellement des anticorps) et myélokathexis (faible nombre de différents granulocytes, des globules blancs non spécifiques).
En 2003, des chercheurs nord-américains établissent la cause génétique de cette maladie rare(2). Elle découle de la mutation d'un gène (CXCR4, présent sur le chromosome 2) codant pour un récepteur situé à la surface de cellules immunitaires. Les globules blancs porteurs de ce gène défectueux restent accrochés, en grappe, aux cellules souches qui leur ont donné naissance, au lieu d'entrer en circulation dans l'organisme. Ceci explique pourquoi les personnes atteintes de WHIM ont une immunité très faible. La maladie est autosomale(3) dominante (la présence du gène défectueux sur un seul des deux chromosomes est suffisante pour que la maladie s'exprime).
"Je vais bien, merci"
En 2014, une femme de 59 ans se rend à l'hôpital de Cincinnati, ses deux filles de 20 ans présentant depuis quelques années tous les symptômes caractéristiques du WHIM. Elle est bien placée pour le savoir : elle est la patiente qui, un demi-siècle plus tôt, avait été auscultée en ces mêmes lieux.
L'analyse génétique confirme que ses filles sont bel et bien porteuses du gène CXCR4 défectueux sur l'un de leur chromosome 2.
– Et vous, madame, comment allez-vous ? – Je vais bien, merci.
Les médecins admirèrent le courage de cette mère, qui vivait depuis tant d'années avec la maladie. "Cela fait une vingtaine d'années que je n'ai plus de symptômes", leur confia-t-elle.
Voilà qui n'était pas normal. Pas normal du tout. Une maladie génétique ne peut pas disparaître toute seule…
Un chromosome légèrement plus court...
Une erreur initiale de diagnostic n'était pas envisageable, la preuve en était ses deux filles, qui présentaient la mutation caractéristique dans leurs gènes. Alors ? A en croire le compte-rendu présenté par les chercheurs début février dans la revue Cell, le sang de la quinquagénaire présentait bel et bien un taux de globules blancs relativement confortable. Mais lorsque les chercheurs examinèrent ces cellules, leur stupéfaction fut totale.
Premier objet d'étonnement, les deux chromosomes 2 de la patiente n'étaient pas exactement de la même taille. Après analyses, le constat était là : dans le noyau de ces cellules, le gène déficient avait été totalement éradiqué. Dans les autres cellules de son organisme, l'anomalie était toujours présente ; mais les globules blancs en circulation étaient totalement fonctionnels.
Le chromosome 2 qui aurait dû porter la copie défectueuse du gène CXCR4 ne présentait plus de copie CXCR4 du tout. Plus surprenant encore : sur toute une portion du chromosome, les gènes se présentaient dans un ordre différent de celui normalement observé.
Les chercheurs ont alors compris ce qui s'était très vraisemblablement produit. Au plus profond de la moelle osseuse de la malade, là où ses cellules souches produisaient des globules blancs trop bien arrimés, était survenu un accident. Plus précisément, une chromothripsis.
Un collier de perles brisé
Une chromothipsis est une anomalie peu fréquente, au cours de laquelle sur toute une portion d'un chromosome, les segments d'ADN se disloquent, se séparant les uns des autres, comme des perles échappées d'un collier. Rapidement, un processus de réparation survient, qui rattache ces "perles" les unes aux autres, et les ressoude au reste du chromosome.
Le plus souvent, le résultat est aberrant, la dislocation s'étant opérée en brisant le code génétique : la cellule ainsi formée peut être non viable, et meurt d'elle-même. Dans d'autres cas, plus graves, le comportement de la cellule ayant été le siège de l'incident devient cancéreux. Plus rarement, le résultat est sans effet notable sur la vie de la cellule : la chromothipsis s'est effectuée en laissant les gènes intacts, ou les gènes lésés sont de peu d'importance.
Chez la patiente de Cincinnati, la chromothipsis ayant eu lieu dans le noyau d'une de ses cellules souches a fait disparaître le CXCR4 anormal.
Toutes les cellules filles de cette cellule souche étaient donc fonctionnelles. Elles inondent depuis 20 ans l'organisme de la patiente. Au cœur de sa moelle osseuse, de nombreuses autres cellules souches restent porteuses de l'anomalie, mais un petit contingent effectue le travail pour elles...
Il est très vraisembable(4) que la chromothipsis qui ait guérit la patiente soit absolument accidentelle. Sur des milliards et des milliards de divisions, l'accident reste probable, et aurait pu conduire à l'émergence d'un cancer. Ici, la patiente en a tiré un merveilleux profit. "L'inactivation partielle [d'un seul gène, dans quelques cellules souches,] pourrait être utilisée comme stratégie thérapeutique, [via] des greffes" résument, enthousiastes, les chercheurs.
Source : Chromothriptic Cure of WHIM Syndrome. D.H. McDermott et coll. Cell. 4 février 2015. doi:10.1016/j.cell.2015.01.014.
-----
(1) Warts (verrues), Hypogammaglobulinemia (hypogammaglobulinémie) Infections (infections) et Myelokathexis syndrome (myélokathexis).
(2) Moins d'une centaine de cas serait recensés dans le monde.
(3) Autosomal signifie que le gène n'est pas porté par un chromosome sexuel.
(4) L'hypothèse d'un mécanisme de défense naturel jusqu'ici inconnu, ayant provoqué la chromothipsis et ciblé le gène, n'est pas avancée par les chercheurs - la vraisemblance étant plutôt du côté du hasard, et des probabilités d'accidents au cours des divisions cellulaires. Pour l'heure, rien ne prouve même que l'accumulation de cellules non fonctionnelles dans la moelle ait augmenté la fréquence des chromothipsis. Mais l'étude approfondie de ce cas clinique pourrait réserver de nouvelles surprises !